Hội đồng Đạo đức thông qua báo cáo giữa kỳ pha 3a vắc xin Nano Covax
Nguồn tin của Tuổi Trẻ Online cho hay báo cáo thử nghiệm giữa kỳ giai đoạn 3 vắc xin Nano Covax đã được Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia thông qua. Hiện cơ quan chức năng đang thẩm định hồ sơ xin phép lưu hành.
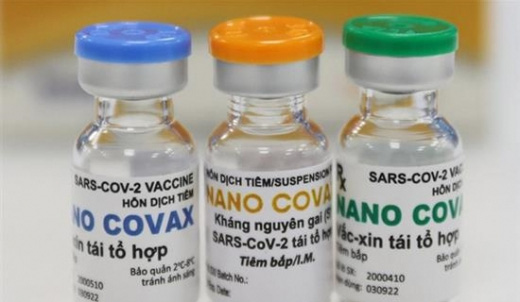
Vắc xin Nano Covax - Ảnh: B.Đ.
Theo thông tin của Tuổi Trẻ Online, Hội đồng Đạo đức trong nghiên cứu y sinh quốc gia đã thông qua báo cáo này hôm 22-8, nhưng có yêu cầu chỉnh sửa báo cáo. Ngày 25-8, báo cáo chỉnh sửa đã được đệ trình lên hội đồng.
Việc thông qua báo cáo thử nghiệm lâm sàng giữa kỳ giai đoạn 3 là mốc quan trọng trong hành trình phát triển vắc xin.
Theo hướng dẫn mới nhất của Bộ Y tế (ban hành ngày 19-8), vắc xin sản xuất trong nước có báo cáo giữa kỳ giai đoạn 3, được Hội đồng Đạo đức thông qua là có thể nộp hồ sơ xin phép lưu hành khẩn cấp.
Bộ Y tế cũng sẽ lấy ý kiến của Hội đồng tư vấn cấp phép lưu hành thuốc và vắc xin, Bộ Y tế, hướng dẫn của Tổ chức Y tế thế giới. Một thành viên Hội đồng tư vấn cấp phép lưu hành thuốc và vắc xin cho biết sau 3 ngày nhận được kết quả từ Hội đồng Đạo đức, Hội đồng tư vấn cấp giấy phép thuốc và vắc xin sẽ họp.
Theo thiết kế nghiên cứu, giai đoạn 3 thử nghiệm lâm sàng Nano Covax được thực hiện đa trung tâm, ngẫu nhiên, có đối chứng giả dược, nhằm đánh giá tính an toàn, sinh miễn dịch, hiệu lực bảo vệ của vắc xin Nano Covax phòng COVID-19 trên khoảng 13.000 đối tượng tình nguyện từ 18 tuổi trở lên.
Có tổng số 13.000 người được tiêm trong giai đoạn 3a và 3b. Hội đồng Đạo đức đã đánh giá giữa kỳ giai đoạn 3a với 1.000 người đã tiêm 2 mũi, qua khảo sát chỉ có 2 trường hợp có phản ứng phản vệ độ 2 (đều hồi phục), còn lại người đã tiêm gặp một số phản ứng như đau vết tiêm, ngứa, sưng nổi cục tại vị trí tiêm, buồn nôn, một số có sốt nhẹ.
Nghiên cứu cũng cho biết trung bình nhân nồng độ kháng thể Anti-S-IgG đạt 57.56 U/ml, tăng gấp 218.93 lần so với D0 (thời điểm trước tiêm). Tỉ lệ chuyển đảo huyết thanh đạt 99,2%. Vắc xin đạt yêu cầu về tính an toàn và sinh miễn dịch.
Nhóm nghiên cứu đề xuất tiếp tục thực hiện giai đoạn 3b, đảm bảo an toàn và đúng tiến độ (12.000 người tham gia) và đề xuất cấp phép khẩn cấp có điều kiện cho vắc xin Nano Covax.
Vắc xin Nano Covax là 1 trong 2 vắc xin nội phát triển tại Việt Nam và là vắc xin có tiến độ nhanh nhất. Nhà sản xuất vắc xin Nano Covax cho biết sẽ bán vắc xin này với giá 120.000 đồng/mũi tiêm và năng lực cung cấp năm 2021 này là 100 triệu liều.
Nếu Nano Covax được cấp phép, đây sẽ là dấu mốc quan trọng trong quá trình chống dịch ở Việt Nam, khi Việt Nam tự chủ được vắc xin. Tính đến ngày 27-8, Việt Nam đã nhận được 27 triệu liều vắc xin và mới có gần 19 triệu liều được sử dụng.

Bộ Y tế đề nghị không lợi dụng tiêm thử nghiệm lâm sàng vaccine Nano Covax vào mục đích thương mại.